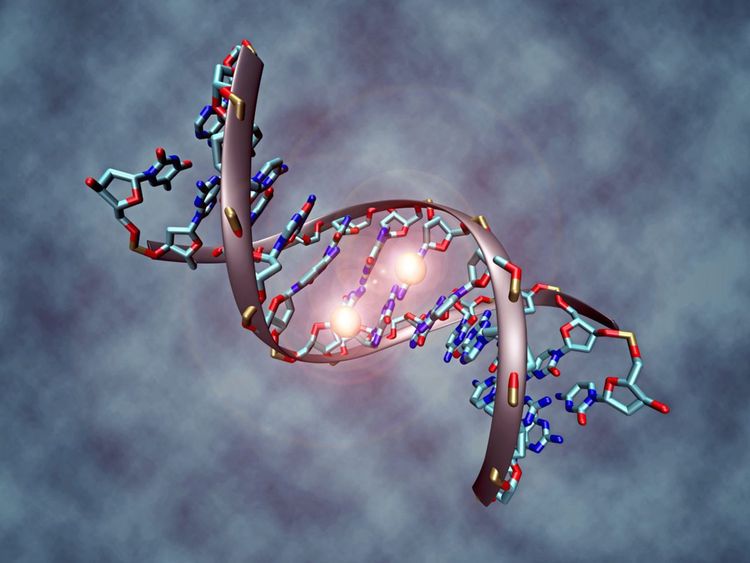
Wenn über die "Genschere" CRISPR gesprochen wird, dann geht es oft um die gezielte Veränderung des Erbguts künftiger Generationen. Mit dabei ist die Angst vor individuell konfigurierten Designerbabys der Reichen und Schönen, bis hin zu einem genetischen Überwachungsstaat, wie er im Film "Gattaca" beschrieben ist.
Dieses Thema wurde im November 2018 wieder einmal akut, nachdem ein chinesischer Wissenschafter öffentlich und zur allgemeinen Überraschung die (gesunde) Geburt von zwei genetisch veränderten Kindern verkündet hatte. Diese Arbeit zeichnet sich allerdings weniger durch besondere wissenschaftliche Exzellenz aus (im Gegenteil, sie war schlampig durchgeführt), sondern vielmehr durch massive Verstöße gegen bestehende Regeln.
CRISPR-Babys in der Kritik
Interessanterweise war die Kritik innerhalb der wissenschaftlichen Community eher stärker ausgeprägt als in der allgemeinen Bevölkerung. Kritisiert wurde insbesondere, dass diese Experimente ohne vorherige Ankündigung und ohne angemessene ethische Begleitung durchgeführt wurden – und dass der medizinische Nutzen für die genetisch veränderten Babys gering ist (sie sind vielleicht resistent gegen HIV).
Die Österreichische Akademie der Wissenschaften und das CeMM-Forschungszentrum für Molekulare Medizin haben sich in einer öffentlichen Stellungnahme von diesen Experimenten distanziert und die Notwendigkeit einer strikten Einhaltung bestehender Regeln für eine ethisch akzeptable Forschung betont. Gleichzeitig wurde in dieser Stellungnahme skizziert, welche Anwendungen von CRISPR unter welchen Umständen vertretbar sein sollten.
Inzwischen haben sich die Wogen wieder etwas geglättet. Der chinesische Wissenschaftler wurde von seiner Universität entlassen und wird sich wohl vor Gericht verantworten müssen. Die genetisch veränderten Babys werden von erfahrenen Ärzten begleitet. Werfen wir also einen Blick auf jene Bereiche, in denen die CRISPR-Technologie abseits der großen Schlagzeilen Fortschritte macht und wo der medizinische Nutzen näherliegt.
Großes Potenzial für die Medizin
CRISPR wird heute in vielen tausend Laboren weltweit eingesetzt, um biologische Prozesse in Zellen zu verstehen. Dabei schalten wir einzelne Gene mit Hilfe von CRISPR gezielt ab und beobachten, welche Auswirkungen das für die Funktion der Zellen hat. Diesen Ansatz, der auch "reverse Genetik" genannt wird, veranschaulicht die Geschichte von einem Genetiker, der eine Autofabrik verstehen will: Täglich fesselt er einem anderen Mitarbeiter die Hände und schaut sich am Ende des Tages an, welche Auswirkungen dies auf die hergestellten Autos hat (kein Lenkrad, keine Fensterscheiben, und so weiter). So versteht er, welcher Mitarbeiter für welche Funktionen zuständig ist.
Die reverse Genetik ist sehr hilfreich für die Entwicklung von Medikamenten. Die meisten Medikamente wirken, indem sie gewisse, durch einzelne Gene definierte Eiweiß-Moleküle in unserem Körper blockieren und damit zum Beispiel unser Schmerzempfinden reduzieren (Aspirin) oder einen Tumor am Wachsen hindern (moderne Krebsmedikamente). Mit CRISPR lässt sich der Effekt neuer Medikamente zumindest teilweise genetisch testen.
Zum Beispiel können wir Krebszellen im Labor erzeugen, bei denen ein bestimmtes Eiweiß-Molekül ausgeschaltet ist, und wir können schauen, ob diese Zellen langsamer wachsen oder besser auf ein bestimmtes Medikament ansprechen. Und wir können für die Medikamentenzulassung vorgeschriebene Tierversuche reduzieren, denn CRISPR erlaubt es uns, genetisch veränderte Mäuse zum Testen von Medikamenten schneller und einfacher zu züchten, sodass für dieselben Ergebnisse zur Sicherheit und Wirksamkeit weniger Versuchstiere nötig sind.

Durch CRISPR erlebt auch das klassische genetische Screening (als "forward genetics" der Gegenpart zur reversen Genetik) eine neue Blüte. Auf der Suche nach Genen, die zum Beispiel für das Wachstum einer Krebszelle wichtig sind, schalten wir mit CRISPR tausende Gene einzeln und zufällig in Millionen von Zellen aus. Anschließend behandeln wir diese Zellen mit einem Krebsmedikament, und zählen mittels DNA-Sequenzierung, welche Gene am Ende des Experiments häufiger oder seltener verändert sind als am Anfang des Experiments.
Wir können damit Gene finden, die für ein neues Medikament wichtig sind – ohne vorher genau zu wissen, welche Arten von Gene in Frage kommen. Viele Kandidaten-Gene für neue Medikamente kommen aktuell aus solchen genetischen Screenings. Allerdings ist es ein weiter Weg von einem "Treffer" in einem Screening bis zum Verständnis der zugrundeliegenden biologischen Mechanismen. Das Screening liefert also nur den Startpunkt für umfangreiche Forschungsarbeiten, an deren Ende zum Beispiel ein neues Krebsmedikament stehen kann.
Schneller zu neuen Medikamenten
Mein Labor am CeMM-Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften arbeitet daher an neuen CRISPR-basierten Methoden, um die Vorteile der reversen Genetik mit der Effizienz von genetischen Screens zu verbinden. Dabei verwenden wir die RNA-Sequenzierung als universellen "Fingerabdruck" der Zelle. Denn aus der Aktivität der Gene können wir viele wesentliche Eigenschaften von menschlichen Zellen ableiten. Allerdings ist es zu aufwändig, für jedes Gen separat CRISPR-editierte Zellen im Labor vorzubereiten.
Daher editieren wir viele Millionen Zellen parallel, genau wie beim klassischen genetischen Screening, und wir sequenzieren mit neuester Technologie die RNA separat für jede einzelne Zelle – statt nur zu zählen, welche genetisch veränderten Zellen besser oder schlechter wachsen. Die CRISPR-Einzelzell-Sequenzierung (auch als CROP-seq oder Perturb-seq bekannt) ermöglicht uns, in einem einzigen großen Experiment die Wirkung von tausenden genetischen Änderungen auf den Zustand unserer Zellen zu verstehen.
Die so entstehenden Datensätze sind besonders interessant für die biomedizinische Forschung, weil sie nicht einfach nur "Treffer" liefern, sondern zum Verständnis der zugrundeliegenden biologischen Mechanismen beitragen. Wir können zum Beispiel direkt beobachten, wenn Krebszellen resistent gegen ein Medikament werden, indem sie die Aktivität ihrer Gene anpassen und sich plötzlich wie eine Stammzelle verhalten.
Diese Forschungen mögen weniger schlagzeilenträchtig sein als die Erschaffung genetisch veränderter Babys. Zugleich bietet die Arbeit mit Krebszellen im Labor auch in ethischer Hinsicht weniger Zündstoff. Der medizinische Nutzen CRISPR-basierter Methoden ist jedoch sehr hoch, ermöglicht es uns doch, die Wirkungsweise von Medikamenten schneller und umfassender zu analysieren. Damit steigen die Chancen für klinische Tests und für den erfolgreichen Einsatz neuer Medikamente gegen Krebs und andere schwere Erkrankungen. (Christoph Bock, 20.2.2019)