Nicht nur die Struktur eines Tumors, auch biologische Daten sind für eine Partikelbestrahlung, wie sie am Ionentherapiezentrum Med Austron durchgeführt wird, interessant.
Bei bestimmten Krebsdiagnosen ist die Partikelbestrahlung als Therapie besonders aussichtsreich. Das Verfahren nutzt Protonen oder Ionen, die – auf zwei Drittel der Lichtgeschwindigkeit beschleunigt – an einem genau definierten Punkt im Körper Energie freisetzen und Krebszellen zerstören.
Gerade bei Tumoren, die tief im Körper liegen oder von sensiblem Gewebe umgeben sind, bietet sich diese Methode an. Die Bestrahlung mit schweren Teilchen kommt dementsprechend häufig bei Tumoren im Kopf- und Halsbereich, bei Lungen- oder Prostatakrebs oder in der Behandlung von Kindern zum Einsatz.
Die Therapie ist aufwendig – immerhin benötigt man einen Teilchenbeschleuniger, der zwar kleiner, aber vom Prinzip her ähnlich jener Anlage ist, die im Nuklearforschungszentrum Cern bei Genf der physikalischen Grundlagenforschung dient.
Gezielter Teilchenstrahl
Dazu kommen ausgeklügelte Steuerungssysteme und Robotik, um den Teilchenstrahl gezielt an die immergleiche Stelle im Körper zu richten. Gleichzeitig braucht es aber auch eine hochentwickelte Diagnostik, die vor und während der Behandlung detaillierte Informationen über die Lage und den Zustand des Tumors sammelt.
In Österreich werden im Ionentherapiezentrum Med Austron in Wiener Neustadt seit 2016 Protonenbestrahlungen durchgeführt. 2019 ist die Variante mit schwereren Kohlenstoffionen dazugekommen. Der Behandlungsbetrieb wird von zahlreichen Forschungsaktivitäten ergänzt – zur Verbesserung und Erweiterung der Therapieform, aber auch für nichtklinische Zwecke.
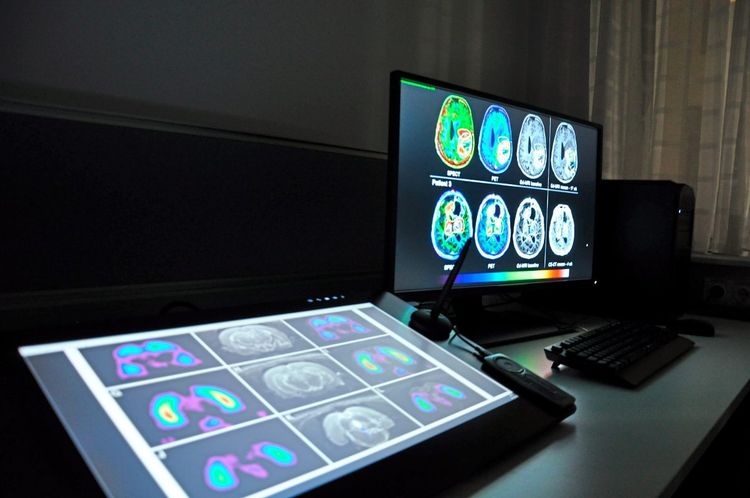
In einer der am Med Austron angesiedelten Forschungsarbeiten geht es um eine vertiefende Analyse der Biologie der Tumoren. In einer Kooperation mit der FH Wiener Neustadt, in der im Rahmen des Studienprogramms Medtech an bildgebenden Verfahren für die Strahlungstherapie geforscht wird, wird nach neuen Möglichkeiten gesucht, die Eigenschaften eines Tumors auf neue Art charakterisieren und visualisieren zu können.
Tumor-Eigenschaften
"Wir arbeiten an der Entwicklung neuer Biomarker, die uns die biologischen Eigenschaften besser verstehen lassen und Informationen für Planung, Kontrolle und Verifikation der Therapien liefern", erklärt Markus Zeilinger, der das Medtech-Programm an der FH Wiener Neustadt leitet.
In der aktuellen Praxis der Strahlenmedizin sind die Computertomografie (CT) und die Magnetresonanztomografie (MRT) die wichtigsten Werkzeuge zur Therapieplanung. Sie ermöglichen auf unterschiedliche Weise – die einen mittels Röntgenschnittbildern, die anderen durch eine Anregung von Wasserstoff-Atomkernen – die Erstellung von 3D-Aufnahmen des Körperinneren.
"Diese Verfahren geben Aufschluss über Form und geometrische Struktur des Tumors. Aufgrund der Daten wird heute geplant, wo bestrahlt werden soll", sagt Zeilinger. Mit Informationen, die auch biologische Charakteristika besser beschreiben, könnte die Therapieplanung aber zusätzlich optimiert werden.
"Kann man einerseits Bereiche im Tumor identifizieren, die biologisch sehr aktiv sind und wo sich Krebszellen schnell teilen, oder andererseits Areale, wo es kaum Stoffwechsel gibt, würde das eine weitere Präzisierung der Strahlungsanwendung ermöglichen", betont der Forscher.
Aufschlussreiche Stoffwechselvorgänge
Dort, wo sich Zellen schnell teilen, wird mehr Energie umgesetzt. Und Energie wird auch in Krebszellen in Form von Zucker – also Glukose – zugeführt. Kann man die Glukose, die in den Zellen aktiv ist, sichtbar machen, lassen sich aus dieser Information auch Rückschlüsse auf die biologischen Eigenschaften des Tumors ziehen.
Dasselbe gilt für eine Reihe weiterer Stoffwechselwege in den Zellen: Die Aktivität spezieller Aminosäuren gibt etwa weitere Anhaltspunkte über den Energiehaushalt der Zellen. Informationen zur Sauerstoffversorgung können Einfluss auf die optimale Strahlendosis der Therapie haben – bei schlecht versorgten Tumorarealen muss sie höher sein.
Um diese Biomarker für die Strahlentherapie bei Tumoren nutzbar zu machen, kommen Mittel der Nuklearmedizin und der Bioinformatik zur Anwendung. Eine der bekanntesten nuklearmedizinischen Anwendung ist die Schilddrüsenszintigrafie: Bei der Untersuchung wird ein Jod-ähnlicher, leicht radioaktiver Stoff injiziert, um auf die Anreicherung von Jod in der Schilddrüse und die damit einhergehende Produktion wichtiger Hormone rückschließen zu können.
Nuklearmedizin
Analog dazu versehen Zeilinger und Kollegen die Ausgangsstoffe des Zellstoffwechsels – wie etwa die Glukosemoleküle – mit einem Radioisotop, dessen Weg im Körper mit den entsprechenden Mitteln sichtbar gemacht werden kann. Bildgebende Verfahren wie die sogenannte Positron Emissions Tomographie (PET) oder die Single Photon Emissions Computer Tomographie (SPECT) messen dabei die Interaktion dieser radioaktiven Substanzen mit Elementarteilchen in ihrer Umgebung im Körper.
Die Radioaktivität, der der Körper dabei ausgesetzt ist, ist – ähnlich wie bei der Schilddrüsenuntersuchung – nicht höher als bei einem Lungenröntgen oder bei einem Transatlantikflug.
Auf diese Weise kann letzten Endes nachvollzogen werden, wie sich die Glukose oder ein anderer mittels Nuklearmedizin sichtbar gemachter Stoff im Tumor verbreitet – wo er sich anreichert, wo er fernbleibt. Auf dem Weg von den Rohdaten dieser Messungen zu einer aussagekräftigen Auswertung ist allerdings noch eine komplexe biomathematische Aufbereitung nötig.
Mathematische Modelle
"Für die Untersuchung sind nur bestimmte Aspekte relevant. Unspezifisch oder nichtgebundene Glukose in Geweben abseits des Tumors oder im Blut gehört etwa nicht dazu", veranschaulicht Zeilinger. "Wir brauchen also spezifische mathematische Modelle der für uns interessanten biochemischen Vorgänge, um die relevanten Informationen aus den Datensätzen herausrechnen und darstellen zu können."
Bis diese Methoden bei Patienten zur Anwendung kommt, werden noch einige Jahre vergehen. Im Moment erproben Zeilinger und Kollegen die Ansätze an Zellkulturen und in Tiermodellen. Letztendlich könnte der Ansatz aber nicht nur der Therapievorbereitung und -kontrolle dienen, sondern sogar der Überwachung des Tumors während der Bestrahlung.
"Theoretisch könnte man die Dosis dann in Echtzeit korrigieren", erklärt der Forscher. "Von einer klinischen Anwendung ist man hier aber noch sehr weit entfernt." (Alois Pumhösel, 30.3.2020)