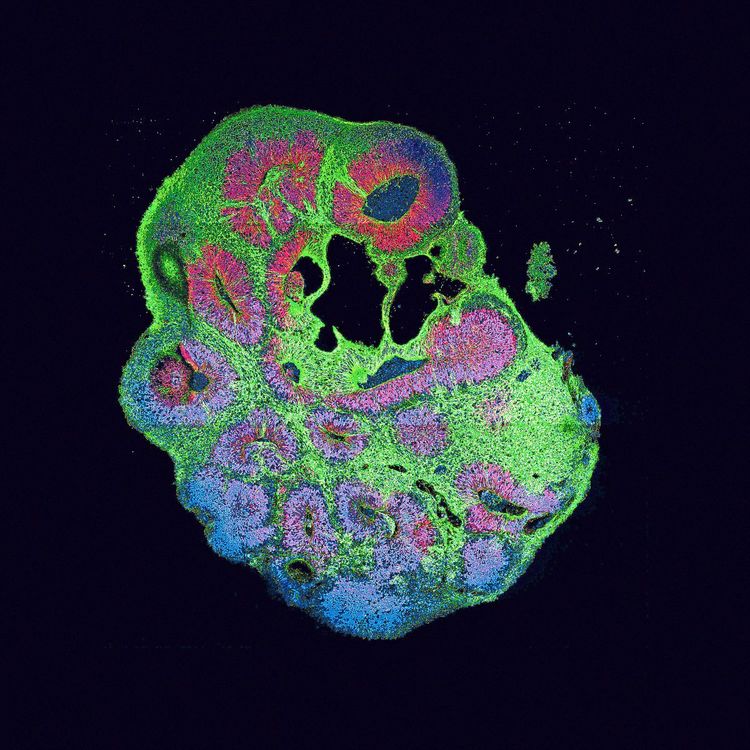
Ein Organoid-Querschnitt mit Stammzellen in Rot, Neuronen in Grün.
Vor etwa mehr als sieben Jahren sorgte ein wissenschaftliches Papier aus Wien für enormes Aufsehen: Aus der Gruppe von Jürgen Knoblich am Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften (ÖAW) kam eine Publikation im Fachmagazin "Nature" über die gelungene Entwicklung von Gehirnorganoiden.
Der damaligen Postdoktorandin des heutigen IMBA-Direktors, der US-amerikanischen Entwicklungsbiologin Madeline Lancaster, gelang die Züchtung von Gehirnzellen in einem 3D-Gewebekomplex aus induzierten pluripotenten Stammzellen (iPS) von bestimmten Patienten mit erblichen Erkrankungen des Gehirns. Eine Methode, die seither im Wiener Labor – und nicht nur dort – angewandt wird, um die Struktur des Organs sowie die Entstehung von Krankheiten wie Autismus, Epilepsie oder Schizophrenie im Detail zu analysieren. Dabei werden ausschließlich einzelne Gehirnregionen gezüchtet oder zwei zusammengeführt, um zu sehen, was auf zellulärer Ebene dabei passiert.
Organoide werden weltweit in vielen Labors produziert – Leber, Herz, Lunge –, es gibt kaum ein menschliches Organ, das nicht auf diese Weise untersucht wird. Nach der Erstpublikation am IMBA zum Thema Gehirnorganoid sagte Jürgen Knoblich dem STANDARD: "Das war schon einer dieser Glücksmomente, wo einfach viel zusammengepasst hat." Man sei gewohnt gewesen, mit der Fruchtfliege zu arbeiten, und sei naiv an die Arbeit herangegangen. "Wir kannten übliche Ansätze nicht, haben nicht genau nachgelesen, was in der Richtung schon gemacht worden war – und haben es anders versucht, weshalb es wohl auch besser funktionierte."
Vorteile gegenüber der Fruchtfliege
Der Vorteil gegenüber dem Tiermodell Fruchtfliege (Drosophila melanogaster) liegt auf der Hand: Die Studien können an menschlichen Zellen durchgeführt werden. Der Nachteil: In den Organoiden konnte man bisher nie viele Gene gleichzeitig testen. Ungleichmäßiges Wachstum in Organoiden machte diese Form des Screenings bisher unmöglich. Dies limitierte das Untersuchen vieler Gene gleichzeitig in einem menschlichen Gewebe.
Eine Einschränkung, die erneut durch eine Arbeit des Knoblich-Labors Geschichte ist: Den Wissenschaftern Christopher Esk und Dominik Lindenhofer gelang es gemeinsam mit einem Team, mehrere Hundert Mutationen in den Gehirnorganoiden gleichzeitig zu erzeugen und parallel ihre Wirkung auf die Gehirnentwicklung zu untersuchen. Auch bei dieser Technik ist die häufig gebrauchte Gen-Schere CRISPR/Cas9 im Spiel, mit der genetische Veränderungen in der Zellkultur schnell und zielgenau bewerkstelligt werden können.
Esk und Co-Autor Lindenhofer, Doktorand am IMBA, haben die Methode aber mit einem doppelten Barcoding kombiniert. Dabei werden jede Zelle im Organoid und die Zellen, von denen sie abstammt, mit einer unverwechselbaren genetischen Adresse versehen, erzählen die beiden Wissenschafter.
Eine Art Zellstammbaum
So sei ein Zellstammbaum entstanden. Man könne den Ursprung jeder einzelnen Zelle im Organoid erkennen und sehen, wie sich der Stammbaum durch Mutationen verändert. Die neue Methode nennen die Wissenschafter CRISPR-LICHT (Lineage Tracing at Cellular resolution in Heterogeneous Tissue). Die Arbeit erschien im Fachmagazin "Science", ihr wurde zuletzt sogar von der Konkurrenz der Zeitschrift, dem Magazin "Nature", ein ausführlicher Artikel gewidmet: keine Alltäglichkeit im Wissenschaftsbetrieb. Esk und Lindenhofer untersuchten die Entstehung der Mikrozephalie, einer Erkrankung des Gehirns, die in einem frühen Stadium der Entwicklung auftritt und nicht heilbar ist. Patienten haben einen deutlich kleineren Kopf als Gesunde und leiden unter schweren Entwicklungsstörungen.
Diese Krankheit kann unterschiedliche Auslöser haben, zum Beispiel Alkohol- und Suchtgiftmissbrauch in der Schwangerschaft der Mutter sowie Infektionskrankheiten wie Röteln oder Zika. Mutationen in bestimmten Genen können jedoch auch Ursprung dieser Krankheit sein, und ein besseres Verständnis dieser Mutationen lässt es zu, Rückschlüsse auf wichtige Prozesse in der Gehirnentwicklung zu ziehen.
Frei wählbare Gene
Durch das Screening entdeckten die Wissenschafter, dass ein Signalweg im endoplasmatischen Retikulum defekt ist, sodass das Gehirn nicht in einem gesunden Ausmaß wachsen kann. Es werden deutlich weniger Nervenzellen produziert als im gesunden Gehirn, das Organ bleibt klein.
Im Zentrum der Arbeit stand aber die Methode, die die Wissenschafter bald im Zusammenhang mit Autismus testen wollen, erzählt Esk. Co-Autor Lindenhofer wird demnächst als Postdoktorand an das Europäische Laboratorium für Molekularbiologie (EMBL) in Heidelberg in Deutschland wechseln. "Die Gene, die man untersuchen will, sowie das Gewebe kann man über diese Technik frei wählen."
Man habe eine Art Plattform geschaffen, die die Szene sehr interessiert. Diese Methode erlaubt es nun, weitere Krankheiten des Gehirns zu untersuchen – neben Autismus auch Schizophrenie und Epilepsie. (Peter Illetschko, 15.2.2021)