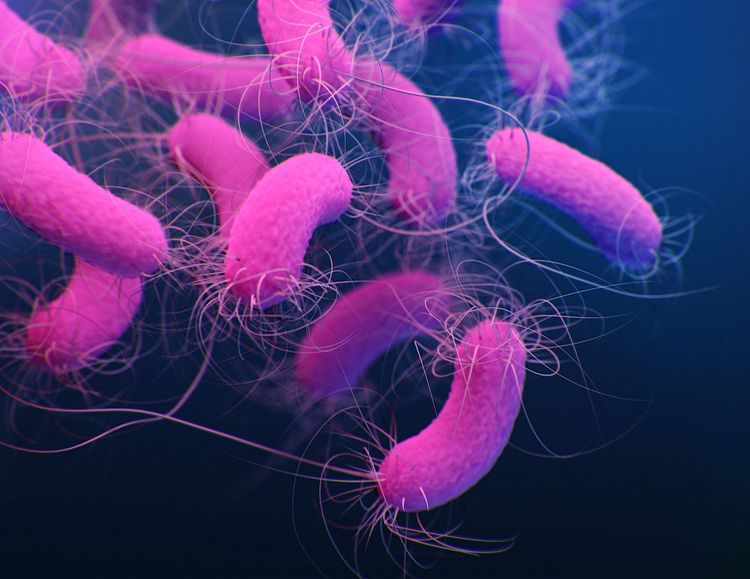
Das Bakterium Pseudomonas aeruginosa besiedelt unter anderem gerne Wasserrohre und medizinische Geräte und kann akute und chronische Infektionen verursachen, die für Menschen mit geschwächtem Immunsystem potenziell tödlich sind. Der Keim zählt zu jenen "Albtraum-Bakterien", die in einzelnen Fällen bereits gegen praktisch jedes verfügbare Antbiotikum resistent sind. Sein Vorhandensein in klinischen Einrichtungen, wo es sich in Beatmungsgeräten und Kathetern vermehren kann, stellt an sich schon eine ernsthafte Bedrohung dar.
Da es darüber hinaus sehr anpassungsfähig ist, wird es immer schwieriger, Infektionen mit diesem Bakterium Herr zu werden. Nun aber ist es Forschern der Universität Genf gelungen, einen entscheidenden Schwachpunkt des Erregers zu identifizieren, einen bisher unbekannten Regulator der Genexpression, dessen Fehlen das Bakterium deutlich abschwächt. Die neuen Ergebnisse könnten entscheidend sein im Kampf gegen diesen Erreger, wie die Wissenschafter in der Fachzeitschrift "Nucleic Acid Research" berichten.
Enzym unter der Lupe
Im Fokus steht eine spezifische RNA-Helikase, ein Enzym, das auch in anderen Krankheitserregern vorkommt, dessen Funktion man bisher aber nicht kannte. "Wir wollten verstehen, welche Rolle diese Helikase spielt, insbesondere in Bezug auf die Pathogenese der Bakterien und ihre Anpassung an die Umwelt", erklärte Martina Valentini, leitende Forscherin in der Abteilung für Mikrobiologie und Molekularmedizin an der medizinischen Fakultät der Uni Genf.
Ihr Team kombinierte biochemische und molekulargenetische Ansätze, um die Funktion dieses Proteins zu ermitteln. "In Abwesenheit dieser RNA-Helikase vermehrt sich P. aeruginosa in vitro normal, sowohl in einem flüssigen Medium als auch auf einem halbfesten Medium bei 37 Grad Celsius", berichtet Stephane Hausmann, wissenschaftlicher Mitarbeiter in der Abteilung für Mikrobiologie und Molekulare Medizin an der medizinischen Fakultät der Uni Genf und Erstautor der Studie.
Infizierte Motten
"Um festzustellen, ob die Infektionsfähigkeit der Bakterien beeinträchtigt wurde, mussten wir sie in vivo in einem lebenden Organismus beobachten." Die Wissenschafter wählten dafür Larven der Großen Wachsmotte (Galleria mellonella), ein Modellinsekt zur Untersuchung von Wirt-Pathogen-Interaktionen. Das angeborene Immunsystem von Insekten hat wichtige Ähnlichkeiten mit dem von Säugetieren. Darüber hinaus gedeihen diese Larven bei menschlicher Körpertemperatur.
Drei Gruppen von Larven wurden beobachtet; in der ersten Gruppe überlebten nach Injektion einer Kochsalzlösung 100 Prozent ihrer Population. In Gegenwart eines normalen Stammes von P. aeruginosa überlebten 20 Stunden nach der Infektion weniger als 20 Prozent. Wenn P. aeruginosa dagegen das RNA-Helikase-Gen nicht mehr besaß, blieben über 90 Prozent der Larven am Leben. "Die modifizierten Bakterien wurden fast harmlos, blieben aber sehr lebendig", sagt Stephane Hausmann.
Suche nach geeignetem Medikament
Die Entschärfung des Bakteriums ist seiner völligen Vernichtung überlegen. "Denn wenn wir versuchen, die Bakterien um jeden Preis zu töten, werden sie sich anpassen, um zu überleben, was das Auftreten resistenter Stämme begünstigt", sagte Valentini. Das Genfer Team testet zur Zeit bekannte Medikamentenmoleküle auf ihre Fähigkeit, dieses Protein selektiv zu blockieren. (red, APA, 22.6.2021)