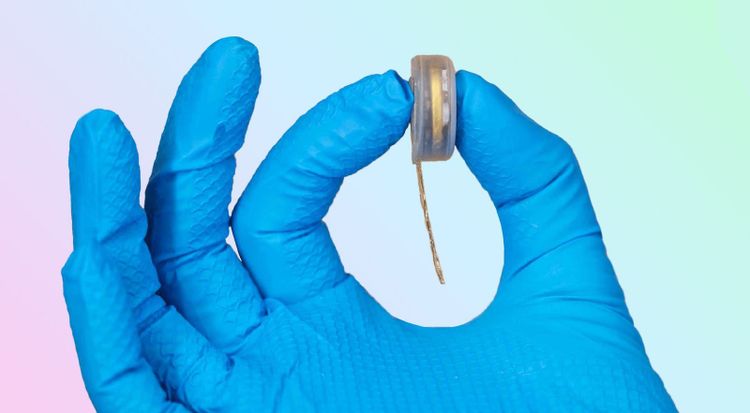
Neuralinks Ziel, bis zum 7. März eine Zulassung für Humanstudien zu erhalten, erscheint unrealistisch.
Geht es nach Elon Musk, werden Gehirnimplantate Krankheiten heilen und die Menschheit dazu ermächtigen, mit künstlicher Intelligenz konkurrieren zu können. Neuralink, sein Unternehmen für die Realisierung dieser Vision, läuft aber alles andere als nach Plan. Ein Bericht deckt nun auf, wie "dutzende Probleme" den nächsten kritischen Meilenstein des Projekts verhindern: die Zulassung für Humanstudien.
Die Ambitionen sind groß, wie bei vielen Unternehmen von Musk: Blinde sollen wieder sehen können, Menschen mit Rückenmarksverletzungen wieder laufen können – und selbst ohne Beeinträchtigung könne es in Zukunft jeder Person freistehen, sich "tunen" zu lassen. Sei es, um sich besondere Fähigkeiten in kürzester Zeit anzueignen oder um mit anderen Neuralink-Nutzern telepathisch Gedanken auszutauschen.
Es ist ein Bild der Zukunft, das die amerikanische Bundeszulassungsstelle für Medizinprodukte, die Food an Drug Administration (FDA), so nicht teilen will: Aus einem Reuters-Bericht geht hervor, warum die Zulassung für Humanstudien abgelehnt worden ist. Und wie gravierend die Sicherheitsbedenken sind.
Technische Mängel
In der Begründung gegenüber Neuralink, die Reuters von ehemaligen Mitarbeitern des Unternehmens geschildert wurde, führt die FDA "dutzende Probleme" an. Die größten Sicherheitsbedenken der Behörde würden die Lithiumbatterie des Geräts betreffen.
Auch die Möglichkeit, dass die winzigen Drähte des Implantats in andere Bereiche des Gehirns wandern, und die Frage, ob und wie das Gerät wieder entfernt werden kann, ohne das Hirngewebe zu beschädigen, stünden einer Zulassung im Weg, so die Mitarbeiter.
Es wird nicht leichter
Die Ablehnung der FDA aus dem Vorjahr bedeutet zwar nicht, dass Neuralink die Zulassung der Behörde für Humantests gar nicht mehr erhalten kann. Sie würde nach Angaben von Experten für FDA-Zulassungsverfahren aber nachfolgende Anträge des Unternehmens auf Genehmigung von Studien erschweren.
Nach eigenen Angaben der FDA hat sie in den letzten drei Jahren etwa zwei Drittel aller Anträge auf Durchführung von Humanversuchen für Geräte im ersten Anlauf genehmigt. Diese Zahl stieg auf 85 Prozent aller Anträge nach einer zweiten Prüfung. Nach drei Versuchen jedoch würden Unternehmen oft aufgeben, anstatt mehr Zeit und Geld in teure Forschungsarbeiten zu investieren.
Toxischer Zeitdruck
Ein Jahr nach der Ablehnung ist Neuralink immer noch damit beschäftigt, die Bedenken der Behörde auszuräumen. Musks öffentliche Prognose, dass Neuralink die FDA-Zulassung im Frühjahr erhalten werde, betrachten die drei ehemaligen Mitarbeiter gegenüber Reuters mit Skepsis. Das Unternehmen könne die bestehenden Probleme nicht so schnell lösen – nicht zuletzt deshalb, weil Neuralink auch mit erheblichen Personalproblemen konfrontiert sei.
Im Vorjahr erhoben ehemalige Mitarbeiter schwere Vorwürfe, wie "Fortune" berichtet hatte. Musk mache kein Hehl draus, dass er mit den Fortschritten bei Neuralink nicht zufrieden sei, und übe "erbarmungslos" Druck aus. Das führe zu unrealistischen Deadlines und in weiterer Folge aufgrund der Unzufriedenheit der Mitarbeiter zu einer hohen Personalfluktuation. Auch von den ursprünglichen acht Gründern ist außer Musk nur noch einer bei Neuralink an Bord. Zuletzt hat Paul Merolla das Unternehmen verlassen, der für das Chipdesign von Neuralink verantwortlich war.
In einem Dokument des Unternehmens vom Herbst heißt es, dass Neuralink dennoch davon ausgeht, dass die FDA bis zum 7. März 2023 Versuche am Menschen für das Gehirnimplantat genehmigen wird. Drei Neuralink-Quellen mit Kenntnissen über die Unternehmenskommunikation mit der FDA sagten jedoch, sie seien nicht zuversichtlich, dass eine behördliche Genehmigung unmittelbar bevorstehe. Jede Vorhersage über den Zeitplan sei ein "Glücksspiel", wie eine der Quellen es gegenüber Reuters ausdrückte. (bbr, 3.3.2023)