Klassische Heureka-Momente gibt es in der heutigen Wissenschaft nur mehr selten. Ähnlich euphorisierend sind aber ihre modernen Äquivalente, die begehrten Bewilligungen von Forschungsförderungen, sogenannte Grants. Eleni Tomazou von der St.-Anna-Kinderkrebsforschung in Wien erhielt kürzlich den Zuschlag für einen zwei Millionen Euro schweren Consolidator Grant des Europäischen Forschungsrates (ERC). Damit wird sie mit ihrer Forschungsgruppe an der Nachbildung eines kindlichen Knochentumors im Labor forschen.
Eingeschränkte Forschung
In der Medizin ist es nötig, eine Krankheit genau zu verstehen, bevor eine Therapie entwickelt werden kann. Zu diesem Verständnis gehören im Fall von Krebs etwa die auslösenden Mutationen, die beteiligten Zelltypen und die verschiedenen Entwicklungsschritte. Besonders für seltene Erkrankungen und Krebsarten, bei denen die Erforschung schon aufgrund der geringen Fallzahlen schwierig ist, stehen deshalb oft nur mangelnde Therapiemöglichkeiten zur Verfügung.
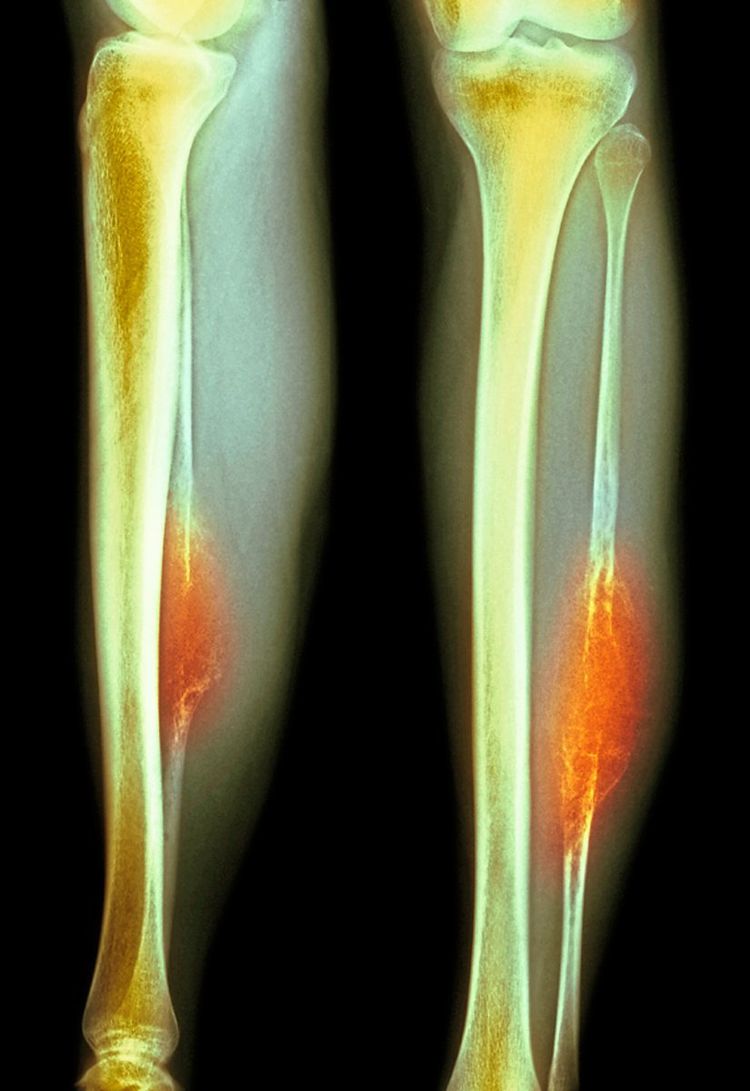
Beim Ewing-Sarkom, der zweithäufigsten Knochenkrebsart bei Kindern, ist die Prognose gut, solange sich keine Metastasen gebildet haben. Bei vorhandenen Metastasen sinkt die Überlebensrate auf etwa 20 Prozent. Da sich die Therapie seit Jahren nicht verändert hat und immer noch vorrangig aus Chemotherapie besteht, sind neue Behandlungsoptionen dringend nötig. Hier kommen Tomazou und ihr Krebsmodell ins Spiel: "Ein Grund, warum die Therapie seit über 30 Jahren kaum verbessert wurde, sind fehlende Möglichkeiten, die Krankheit zu erforschen", sagt sie. "Selbst wenn jemand eine Idee für eine neue Behandlung hätte, gibt es keine Modelle in Zellen oder Mäusen, um sie zu testen."
Tumormodell für Medikamentests
Es ist zwar bekannt, was die auslösende Mutation ist, aber nicht, in welchem Zelltyp sie stattfinden muss, damit sich daraus ein Ewing-Sarkom entwickelt. Die verantwortliche Mutation ist eine fehlerhafte Kombination zweier Gene, aus denen ein Protein mit dem Namen EWS-FLI1 gebildet wird. Wird dieses EWS-FLI1-Fusionsprotein in Bindegewebszellen gebildet, deren Eigenschaften dafür empfänglich sind, entsteht daraus der Tumor. Es ist unbekannt, welche Art von Bindegewebe beteiligt sein muss und in welchem Entwicklungsstadium und Alter die Zelle zum Zeitpunkt der Mutation sein muss.
In ihrem bald mit dem ERC-Grant finanzierten Forschungsprojekt will die 42-Jährige menschliche pluripotente Stammzellen nützen. Diese können sich in viele verschiedene Zellarten entwickeln. In diesen regt die Forscherin in unterschiedlichen Entwicklungsstadien die Bildung des EWS-FLI1-Fusionsproteins an. Entwickelt sich daraus etwas, das wie das tatsächliche Ewing-Sarkom aussieht, kann auf die entsprechenden Ausgangsbedingungen im menschlichen Körper geschlossen werden. Über den verwendeten Zelltyp und -zustand könnte das Team ein Tumormodell wachsen lassen, an dem potenzielle Medikamente getestet werden könnten.
Drei Herangehensweisen
Drei gleichzeitig verfolgte Strategien sollen Tomazou dabei zu den richtigen Zelleigenschaften führen. Die erste Strategie beruht auf der Crispr/Cas9-Technologie, bei der nicht nur das Genom gezielt verändert werden kann, sondern auch die übergeordneten Regulatoren der DNA ein- und ausgeschaltet werden können. So können die pluripotenten Stammzellen dazu gebracht werden, sich in verschiedene Richtungen zu entwickeln und eventuell die richtigen Bedingungen für das Fusionsprotein zu schaffen. Bei der zweiten Methode wird die Entwicklung der pluripotenten Zellen durch Wachstumsfaktoren angeregt, während sie dreidimensionale Zellansammlungen bilden. Dies hat den Vorteil, dass dabei die Struktur von Zellen mit dem Fusionsprotein durch Zellen ohne das Protein gestützt wird, ähnlich wie bei Krebs sowohl Tumorzellen als auch gesunde Zellen vorhanden sind.
Bei der dritten Methode werden die pluripotenten Stammzellen in Mäuse eingepflanzt, woraufhin sich Teratome bilden. Ein Teratom ist ein meist gutartiger Tumor, in dem unabhängig vom Körperteil so unterschiedliche Gewebetypen wie Haare oder Zähne wachsen. Dies wird genützt, um möglicherweise voll entwickelte Ewing-Sarkome in lebenden Organismen nachzubilden. Besonders der dritte Weg wurde so noch nicht versucht und geht mit dem Risiko eines Fehlschlags einher, weiß auch Tomazou: "Diese Methode klingt vielleicht verrückt, aber der ERC-Grant unterstützt solche High-risk-high-gain-Ansätze, bei denen hohes Risiko einem hohen Nutzen gegenübersteht."
Der medizinische Nutzen wäre bei positivem Ergebnis eines der drei Wege immens: Dadurch könnten Wirkstoffe entwickelt werden, die den Tumor direkt an der Wurzel bekämpfen. "Außerdem gehen wir davon aus, in diesem Projekt grundsätzliche biologische Mechanismen besser verstehen zu lernen, die weit über das Ewing-Sarkom hinaus gültig und damit auch für andere Erkrankungen relevant sein können", ergänzt Tomazou. Ihre Forschungsgruppe wird derzeit neben der Unterstützung der St.-Anna-Kinderkrebsforschung durch den Wissenschaftsfonds FWF und den Wiener Wissenschafts-, Forschungs- und Technologiefonds finanziert. Das Volumen des ERC-Grants geht deutlich über jenes nationaler Förderungen hinaus und eröffnet neue Möglichkeiten zusätzlich zur Finanzierung von Experimenten. Mit dem neuen Grant plant sie, drei bis vier weitere Mitarbeitende anzustellen.
Freude und Leistungsdruck
Die in den USA geborene Griechin blickt auf eine höchst internationale Laufbahn: Nach Studium in Schottland, PhD in Cambridge und Postdoc in Harvard arbeitete sie für das amerikanische Rote Kreuz und ist nun seit 2012 bei der St.-Anna-Kinderkrebsforschung tätig. Sobald die Verträge mit der EU abgeschlossen sind, könnte die fünfjährige Laufzeit der Förderung heuer beginnen und ihre Zeit in Wien verlängert werden. "Wissenschaft ist teuer. Der ERC-Grant ist deshalb eine einzigartige Gelegenheit, da wir damit wirklich langfristig planen können", sagt Tomazou. Neben der Euphorie spürt sie auch einen gewissen Druck, dass die große Geldsumme gute wissenschaftliche Ergebnisse mit sich bringen soll. Eine Herausforderung, die sie aber gerne annimmt: "Das Limit sind jetzt nur mehr wir selbst. Es gibt keine Ausreden. Wir haben die Möglichkeiten, und es liegt an uns, etwas Großartiges daraus zu machen." (Markus Plank, 1.4.2023)