
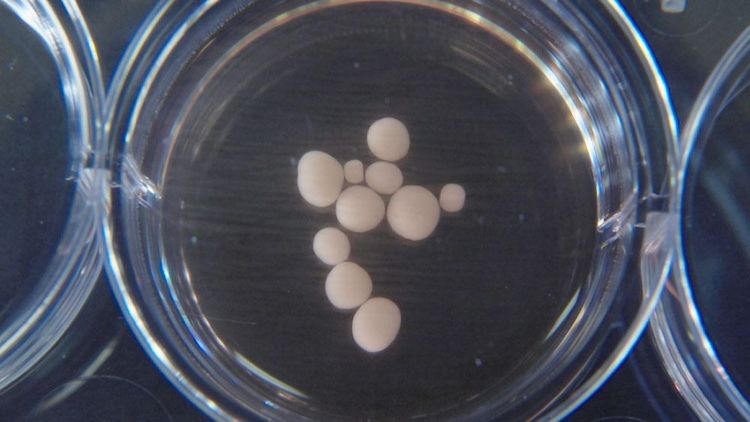
Die Revolution fand im Becher statt. Vor zehn Jahren schwamm ein Zellhaufen, der wie eine weiße Erbse aussieht, in der Nährlösung. Dieses Gehirn-Organoid im Wiener Labor von Jürgen Knoblich basierte auf menschlichen Stammzellen. Der Clou dabei war: Erstmals konnte das Team um Knoblich und Postdoktorandin Madeline Lancaster Organoide nutzen, um eine Krankheit, die das menschliche Hirn betrifft, in frühen Entwicklungsphasen abzubilden. Bei der Erkrankung handelte es sich um Mikrozephalie, bei der das Gehirn viel kleiner als im Durchschnitt ist.
Damit gelang dem Team am Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften (ÖAW) eine der wichtigsten Forschungsarbeiten der vergangenen 20 Jahre. Was sich seither in der Organoidforschung getan hat, welche Fragen sie nicht beantwortet und was Menschen und Mäuse unterscheidet, erzählt der deutsche Molekularbiologe im Gespräch.
STANDARD: Wie stehen Sie zum Begriff "Mini-Hirn"?
Knoblich: Ich halte ihn für grundlegend falsch und ethisch problematisch. Anfangs hätten wir uns nie vorstellen können, welche Ideen die Leute damit verknüpfen. So cool er vielleicht klingt: Er löst Ängste aus. "Mini-Hirn" suggeriert, dass wir ein Gehirn in Kleinformat züchten, was überhaupt nicht stimmt. Wir bauen kein Gehirn im eigentlichen Sinn, sondern stellen Aspekte der Hirnentwicklung in Zellkulturen nach, um sie zu untersuchen. Daher raten wir mittlerweile klar davon ab, ihn zu verwenden.
STANDARD: Was können wir durch die Erforschung von Organoiden lernen?
Knoblich: Wir können zum Beispiel Vorgänge der Organentwicklung studieren, die nur bei Menschen und nicht bei anderen Tieren stattfinden. Hier unterscheiden wir uns schon allein auf genetischer Basis: Bestimmte Mutationen lösen in unserem Erbgut Krankheiten aus, bei Versuchstieren aber nicht. Man kann sie also nicht im Tierversuch erforschen.
STANDARD: Worin unterscheiden sich Menschen- und Mäusegehirne?
Knoblich: Die menschliche Hirnentwicklung dauert viel länger, und wir haben wesentlich mehr Nervenzellen – 87 Milliarden. Ein menschlicher Fötus stellt während der gesamten neun Monate Schwangerschaft innerhalb von sechs Stunden die Menge an Neuronen her, die ein Mäusegehirn hat. Bei der Geburt eines Babys ist das Gehirn noch nicht komplett, eine unglaubliche Menge an Nervenzellen wandert erst nach der Geburt ein. Und während das menschliche Hirn gefaltet ist, ist das einer Maus glatt. Auch die Komplexität der einzelnen Nervenzellen unterscheidet sich.
STANDARD: Wenn man Organoide statt Mäuse züchtet, lassen sich Tierversuche vermeiden.
Knoblich: Das ist eine weitere wichtige Bedeutung dieser Forschung. Mein Labor hat die Organoide vor zehn Jahren ursprünglich entwickelt, weil wir für ein ganz bestimmtes Projekt sehr viele Mäuse hätten töten müssen und das nicht wollten. Gleichzeitig warne ich vor Aussagen wie "Wir werden Tierversuche in den kommenden fünf bis zehn Jahren ganz abschaffen". Falls das je gelingt, wird es viel länger dauern. Wir machen Tierversuche zwar zielgerichteter und ersetzen sie teils. Das geht aber nicht in allen Forschungsbereichen. Sie verbieten zu wollen, weil es Organoide gibt, halte ich für unverantwortlich.
STANDARD: Welche Krankheiten lassen sich durch Organoide gut erforschen, welche weniger?
Knoblich: Schizophrenie ist beispielsweise sehr schwierig abzubilden, etwa weil die genetischen Ursachen nicht klar sind. Einfacher ist es bei Epilepsie, wo sich derzeit viel in der Forschung tut, und bei Autismus. Andere Ebenen – Intelligenz, Persönlichkeit – sind durch Organoide sicher nicht zu erforschen.
STANDARD: Zuletzt gab es Berichte darüber, dass Autismus bei Frauen seltener diagnostiziert wurde, weil sich bei ihnen die Krankheit oft durch andere Symptome zeigt. Wie sieht es mit der Analyse unterschiedlicher Ausprägungen aus?
Knoblich: Autismus ist bei Frauen weniger häufig – das ist eine Tatsache. Ich denke eher, dass heutzutage mehr Menschen mit Autismus diagnostiziert werden, weil sich mehr Leute trauen, damit zum Arzt zu gehen. Die mangelnde Diversität von Stichproben, etwa bei Geschlecht und ethnischer Herkunft, ist auch in der Stammzellforschung ein wichtiges Thema. Verschiedenheiten zwischen männlichen und weiblichen Zellkulturen festzustellen ist in Organoiden aber problematisch.
STANDARD: Warum?
Knoblich: Die geschlechtsspezifischen Unterschiede in der Gehirnentwicklung sind in erster Linie hormonell bedingt. Dieser Einfluss fehlt bei Organoiden. Da ist es in den Anfangsstadien nicht der Genotyp, sondern der Einfluss der Hormone, der die Ausprägung des Geschlechts beeinflusst. Eine Studie von Madeline Lancaster, die ja in meinem Labor das erste Mal Gehirnerkrankungen in Organoiden untersucht hat, zeigte klar, dass man solche Unterschiede nur sieht, wenn man die gleiche Stammzelllinie entweder mit Östrogenen oder mit Androgenen behandelt. Ich möchte nur vor einer zu starken Verallgemeinerung warnen, weil sich geschlechtsspezifische Vorgänge nicht identisch in Organoiden darstellen lassen.
STANDARD: Sind Sie noch in regem Kontakt mit Madeline Lancaster?
Knoblich: Ja, wir stehen in ständigem Austausch. Ich freue mich, dass sie am britischen Medical Research Council in Cambridge ihre eigene Forschungsgruppe gründen konnte. Natürlich hat sie die Technologie, die sie in meinem Labor entwickelt hat, mitnehmen können. Wir finden es sinnvoll, dass ihre und meine Gruppe an Organoiden forschen. Dabei arbeiten wir an unterschiedlichen Themen und versuchen, Redundanzen zu vermeiden.
STANDARD: Was können wir denn ausdrücklich nicht von Organoiden lernen?
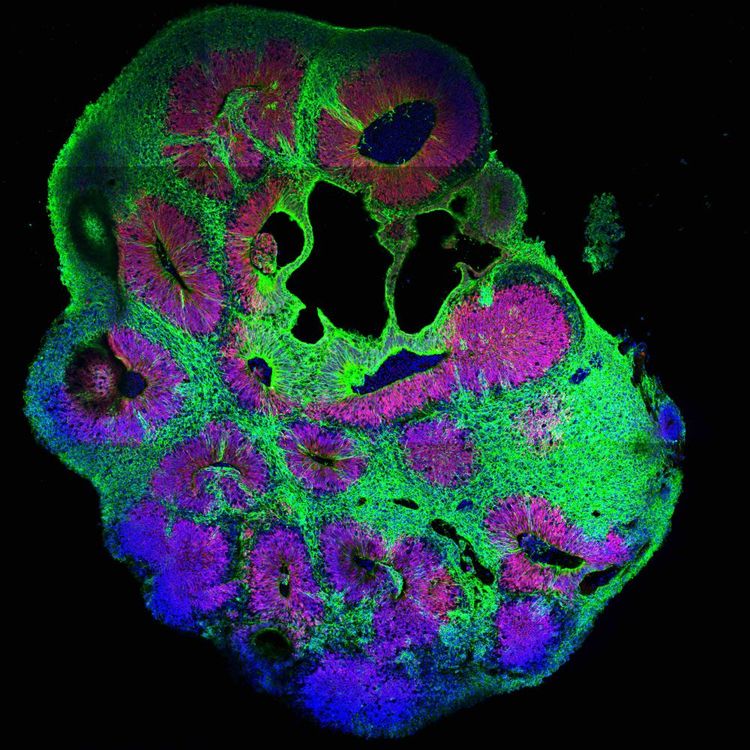
Knoblich: Sie können uns nicht beibringen, wie sich menschliches Verhalten zwischen zwei Personen unterscheidet. Unterschiede zwischen kranken Patientinnen und Gesunden kann man nur feststellen, wenn sie stark sind. Subtile Verschiedenheiten werden durch die hohe Variabilität verdeckt. Je länger man Organoide wachsen lässt, desto chaotischer werden sie und entsprechen immer weniger einem menschlichen Gehirn. Und: Organoide haben nichts, was einer Art Intelligenz nahekäme.
STANDARD: Manche Forschende behaupten, Organoide könnten künftig in manchen Bereichen besser als Computer arbeiten.
Knoblich: Ich kann mir nicht vorstellen, dass sie Computer ersetzen – angesichts der Kosten und Probleme, Neuronen zu züchten, und der Komplexität von Computern. Für realistisch halte ich hingegen Schnittstellen zwischen Maschinen und Gehirn, etwa Implantate, die den Beginn eines epileptischen Anfalls erkennen und Medikamente abgeben.
STANDARD: Welche großen Probleme haben sich neben der hohen Variabilität ergeben?
Knoblich: Die größte Schwierigkeit ist die Zeit – und das nervt unglaublich. Menschliche Organoide entwickeln sich extrem langsam, im gleichen Tempo wie ein menschlicher Fötus. Man muss also sehr lange warten. In anderen Aspekten glaube ich, dass wir fixe Grenzen erreicht haben: Organoide können sich nicht wie ein menschliches Gehirn falten. Ich halte es auch für komplett ausgeschlossen, dass Organoide denken können. Dafür funktionieren aber andere Dinge. Die neuronale Netzwerkarchitektur ist einem wirklichen Gehirn ähnlich. Davon können wir schon sehr viel lernen.
STANDARD: Welche Erfolge sind in den vergangenen zehn Jahren gelungen?
Knoblich: Medizinische Lehrbücher wurden basierend auf unseren Erkenntnissen umgeschrieben, viele Erkrankungen und Störungen konnten wir abbilden. Beispielsweise haben wir den Dopamin-Schaltkreis nachgebaut, der für Suchtverhalten verantwortlich ist. So lässt sich studieren, wie Kokain funktioniert. Bei der tuberösen Sklerose haben wir gelernt, dass sie anders entsteht als vom Tiermodell vorhergesagt. Denn eine wichtige Rolle spielt ein Zelltyp, den es bei Mäusen nicht gibt. Eine andere Forschungsgruppe zeigte, dass das Zika-Virus beim Fötus Mikrozephalie auslösen kann, wenn Schwangere infiziert werden. Einige Biotechfirmen arbeiten bereits mit Organoiden, eine davon habe ich selbst mit Madeline Lancaster gegründet. Ich bin zuversichtlich, dass schon bald die ersten Medikamente für Gehirnerkrankungen mithilfe von Organoidmodellen entwickelt werden. (Interview: Julia Sica, 28.5.2023)