Wenn wir übermäßig und viel schlemmen, hat auch der Fettstoffwechsel übermäßig viel zu tun. Er spielt eine wichtige Rolle für den Energiehaushalt und sorgt dafür, dass sogenannte Lipide im Körper dorthin geschickt werden, wo sie gerade benötigt werden. Wie viel Fett wir aufnehmen und wie viel wieder abgegeben wird, gibt der Darm vor. Er bildet eine Barriere zwischen dem körpereigenen Fett und den Lipiden, die wir mit der Nahrung aufnehmen.
Veränderte Proteine
Zu viel des Guten kann bekanntlich zu zusätzlichen Pfunden führen. Allerdings können Übergewicht oder Fettleibigkeit auch durch eine Fettstoffwechselstörung verursacht werden. Verantwortlich dafür sind Veränderungen verschiedener Proteine, die an Fettstoffwechselprozessen beteiligt sind. Das Ziel der Biochemikerin Melanie Korbelius ist es, diese Proteine zu identifizieren und zu analysieren, um zu einem besseren Verständnis des Fettstoffwechsels im Darm beizutragen. Die Wissenschafterin forscht am Lehrstuhl für Molekularbiologie und Biochemie, Gottfried-Schatz-Forschungszentrum der Med-Uni Graz, und konnte jüngst einen bisher noch nicht bekannten Lipidspeicher im Darm identifizieren.
Fett, das über die Nahrung aufgenommen wird, wird grundsätzlich in Lipoproteine verpackt und in die Blutbahn geschickt, um periphere Organe wie etwa die Leber mit Energie zu versorgen. Doch wenn zu viel Fett aufgenommen wird, führt dies zu einer erhöhten Abgabe in den Blutkreislauf, was zu erhöhten Blutfettwerten und in weiterer Folge zu Arteriosklerose führen kann. Darüber hinaus kann es auch zu einer Zwischenspeicherung im Darm selbst kommen.
Zwischenspeicher im Darm
Wenn der Darm weniger Fett in die Blutbahn abgeben kann, als ihm zugeführt wird, speichert er diesen Überschuss temporär. Wird in weiterer Folge Fett benötigt – etwa bei sportlicher Betätigung oder weil kein Fett durch die Nahrung aufgenommen wird –, kann er diese vorübergehend gespeicherten Lipide wieder abgeben. Im Körper gibt es auch abseits des Darms Lipidspeicher, etwa im Fettgewebe. "Ein wichtiger Teil unserer Forschung ist es daher auch, jenen Fettspeicher zu charakterisieren, welcher für die erhöhten Blutfettwerte verantwortlich ist", sagt Korbelius.
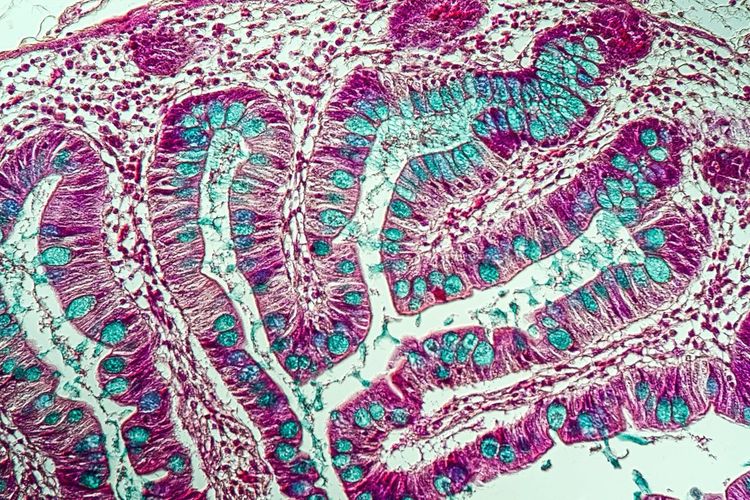
Der Hauptbestandteil von mit der Nahrung zugeführten Lipiden sind die sogenannten Triglyzeride: Diese müssen – bis sie als Energielieferanten in anderen Geweben zur Verfügung stehen – zerlegt, aufgenommen, wieder zusammengesetzt und schließlich in die Blutbahn abgegeben werden. In diesem Prozess spielen Enzyme eine wichtige Rolle. Mittelpunkt der Forschung von Korbelius waren das Enzym ATGL und das Protein CGI-58. Bei Letzterem handelt es sich um einen Co-Aktivator, der die Aktivität des fettspaltenden Enzyms ATGL stimuliert.
Im Zuge der wissenschaftlichen Arbeit wurden Labormäuse untersucht, die eine darmspezifische Mutation zweier Gene (Pnpla2 für ATGL und Abhd5 für CGI-58) hatten, wodurch das Enzym ATGL in den Darmzellen nicht funktionierte. Bereits bei einer normalen Diät, aber auch wenn gar kein Fett über die Nahrung aufgenommen wurde, konnte eine drastische Ansammlung von Fetten im Darm dieser Mäuse beobachtet werden. Übereinstimmend damit zeigten frühere Studien bereits, dass ein Fehlen von ATGL zu Fettansammlungen in verschiedensten Geweben wie der Leber oder dem Herz führt.
Leuchtende Fette
"Die essenzielle Rolle des Enzyms im Lipidabbau wird besonders in Labormäusen, bei welchen ATGL im gesamten Körper nicht vorhanden ist, deutlich: Denn diese sterben bereits nach zwölf bis 14 Wochen an Herzverfettung, obwohl sie normalerweise eine Lebensdauer von etwa zwei Jahren haben", sagt Korbelius. Im Gegensatz dazu führt das Fehlen von CGI-58 im gesamten Körper zu einer gestörten Hautbarriere, wodurch die betroffenen Mäuse überhaupt nicht lebensfähig sind.
Das Fehlen von ATGL und CGI-58 spezifisch im Darm führte zwar zu massiven Fettansammlungen im Darm selbst, die Blutfettwerte wurden dadurch aber nicht drastisch verändert. Diese Erkenntnis weist erstmals darauf hin, dass es mehr als einen temporären Fettspeicher in unseren Darmzellen geben muss. Um mehr über den Fettstoffwechsel und die Lipidspeicher im Darm zu erfahren, führten Korbelius und ihr Team bereits verschiedene Versuche durch. So wurde Mäusen etwa fluoreszierende Fettsäuren mittels Magensonde verabreicht. Danach wurde beobachtet, was mit diesen Fettsäuren im Körper passiert und in welchen Lipidspeicher sie eingebaut werden.
Durch Ultrazentrifugation können die Lipidspeicher einzeln von den Darmzellen isoliert werden. So können diese gesondert untersucht werden. In Zukunft könnten diese Erkenntnisse Grundlage für neue pharmazeutische Behandlungsmethoden sein, indem etwa nur jener Lipidspeicher gezielt angegriffen wird, der mit erhöhten Blutfettwerten in Verbindung steht. Ihre Forschung brachte Korbelius bereits jetzt Anerkennung: Für ihre Arbeit wurde sie mit dem L’Oreal-Stipendium für Frauen in der Wissenschaft ausgezeichnet.
(Karin Grabner, 10.2.2023)